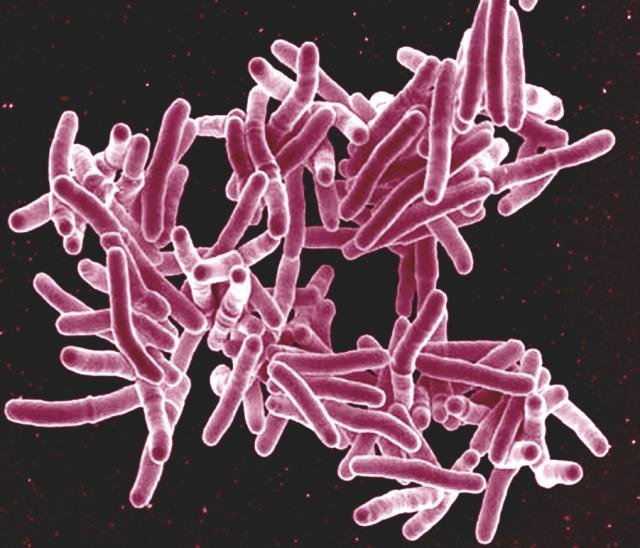
Антибактериальные войны
С тех пор как в начале XX века Александр Флеминг открыл свойства плесени рода Penicillium, человечество выделило несколько тысяч антибиотиков, но в какой-то момент каждый из них переставал работать. Почему бактерии становятся неуязвимыми? И сможем ли мы бесконечно создавать все новые формы лекарств против них?
Древнее «оружие»: появление и назначение
Когда 500 миллионов лет назад на Земле появились грибы, бактерии уже жили на ней больше 3 миллиардов лет. Конкурируя, микроорганизмы выработали механизмы борьбы за существование. Так, грибы научились синтезировать антибиотики, которые блокируют жизненно важные функции бактерий, атакуя их белки. Есть несколько механизмов воздействия антибиотиков на бактерий. Одни разрушают клеточную стенку или мембрану и препятствуют их восстановлению, другие нарушают синтез и целостность ДНК и РНК, третьи — производство белков, а четвертые — фолиевой кислоты, участницы энергетического обмена.
Однако антибиотики также участвуют и в детоксикации, обмене веществ, помогают организму «взрослеть» и запасать питательные вещества. Ученые считают, что антибактериальные вещества изначально не были «оружием», и их свойство проявилось случайно и закрепилось эволюцией. Некоторые микробиологи утверждают, что это реликт древних внутриклеточных механизмов производства белка, существовавший до появления рибосом.
Раньше Флеминга
Существует несколько версий того, как Александр Флеминг в 1928 году открыл первый антибиотик. По самой распространенной из них, ученый посеял стафилококк в питательную среду и уехал на весь август отдыхать ссемьей. По небрежности перед отъездом он занес в чашку споры плесени. Вернувшись, Флеминг обнаружил, что разросшийся грибок отгородился от остальной среды прозрачной жидкостью, в каплях которой бактерии умирали.
Почти за 70 лет до этого два русских врача Алексей Полотебнов и Вячеслав Манассеин независимо друг от друга исследовали зеленую плесень. Оба пришли к выводу, что она уничтожает бактерии. Однако Полотебнов пошел дальше коллеги и приготовил на основе грибка эмульсию — первый антисептик. В 1872 году он опубликовал статью «Патологическое значение плесени», но научное сообщество не обратило на нее должного внимания.
Заимствование: поиск новых антибиотиков
Новые антибиотики ищут тремя способами. Первый — поиск организмов, способных производить новые бактерицидные (убивают бактерии) и бактериостатические (подавляют их размножение) вещества. Второй — направленный синтез соединений, блокирующих жизненно важные белки болезнетворных микробов. И третий — анализ генов видов, производящих известные антибиотики.
Первый метод называют скринингом, и через него проходят тысячи различных организмов. Если исследователи находят нужный, они тестируют его на группы известных инфекций и затем выращивают в крупных масштабах, чтобы выделить из него антибактериальное соединение.
При втором способе молекулярные биологи определяют белки, присутствующие у большинства болезнетворных бактерий. Затем ищут у микроорганизмов гены, отвечающие за вещества, способные блокировать эти белки. После биотехнологи создают клетки, производящие новый препарат.
Третий метод похож на второй. Ученые исследуют микроорганизмы, производящие известные антибиотики, ищут неактивные гены, включают их и получают клетку, продуцирующую новые вещества. Затем микробиологи проверяют молекулу на бактерицидные или бактериостатические свойства.
Во благо человечества: разработка и производство
 Когда антибиотик найден, ученые придумывают, как выделить его и максимально очистить. Многие природные антибактериальные соединения нестабильны, токсичны или плохо растворимы. Чтобы придать веществу лучшие фармакологические свойства, его модифицируют. Так, известно более 30 000 природных антибиотиков, из которых в медицине применяется только 150.
Когда антибиотик найден, ученые придумывают, как выделить его и максимально очистить. Многие природные антибактериальные соединения нестабильны, токсичны или плохо растворимы. Чтобы придать веществу лучшие фармакологические свойства, его модифицируют. Так, известно более 30 000 природных антибиотиков, из которых в медицине применяется только 150.
Фармакологи в свою очередь подбирают эффективную лекарственную форму: мазь, таблетка, аэрозоль, сироп и прочее. Дальше медики-ученые проводят доклинические испытания активного вещества на животных и клинические на людях. Проверки занимают не меньше пяти лет. После успешного прохождения всех этапов Министерство здравоохранения утверждает препарат и дает разрешение на его продажу в России. В странах Евросоюза регистрацией лекарств занимается European Medicines Agency (EMA), а в США — Food and Drug Administration (FDA).
В промышленности антибиотики получают в основном из живых организмов. Для этого их помещают в питательную среду и провоцируют синтезировать необходимое вещество. Его выделяют, очищают и «фасуют». Однако использовать живые клетки дорого и трудно. Поэтому, если выделенная молекула достаточно простая в строении, химики ищут способ синтезировать ее искусственно. Зачастую это снижает цену на готовое лекарство и делает его доступнее для потребителя.
Фармацевтическая компания «ВЕРТЕКС»
— Самый сложный, ответственный и определяющий этап, предшествующий производству любого препарата, — его разработка. Она учитывает множество параметров и характеристик: состав, концентрацию, скорость высвобождения и всасывания действующего вещества в определенных отделах желудочно-кишечного тракта, возможность массового производства препарата, стабильность лекарства в течение срока годности и другое.
В антибиотике доза действующего вещества достаточно высокая, активной фармацевтической субстанции нужно много. При этом ее надо поместить, например, в одну небольшую таблетку. Здесь будет играть роль, как субстанция сыпется, прессуется. Сырье могут обработать, чтобы оно стало более податливым и подходящим для придания формы. Она, в свою очередь, также влияет на особенности производства. К примеру, выпуск лекарств с пролонгированным действием более сложный.
Изначально для создания антибиотиков использовали метод микробного синтеза, но потом стали стараться получать их и химически. Например, левомицетин был получен из культур клеток Streptomyces venezuelae, а впоследствии синтезирован химическим путем. Иногда способы совмещают — например, есть полусинтетические пенициллины.
Разница в эффективности зависит не от происхождения, а от спектра активности каждого конкретного антибиотика. А также от частоты использования: самые сильные — антибиотики резерва, их стараются использовать реже и в самых тяжелых ситуациях, чтобы медленнее развивалась резистентность.
Бесконечная борьба: причина резистентности
 Наследственная информация бактерии устроена достаточно просто и легко адаптируется под меняющиеся условия. Сама клетка живет около получаса, в конце которого делится, поэтому в колонии бактерий обязательно найдется одна, которую антибиотик лишь ослабит, а не убьет. Она размножится и образует новую популяцию. Благодаря этому бактерии легко вырабатывают устойчивость к «оружию».
Наследственная информация бактерии устроена достаточно просто и легко адаптируется под меняющиеся условия. Сама клетка живет около получаса, в конце которого делится, поэтому в колонии бактерий обязательно найдется одна, которую антибиотик лишь ослабит, а не убьет. Она размножится и образует новую популяцию. Благодаря этому бактерии легко вырабатывают устойчивость к «оружию».
Это свойство — резистентность — сегодня стало одной из масштабных проблем медицины во всем мире. В конце декабря 2020 года Госдума РФ приняла Федеральный закон о биобезопасности, направленный на «защиту населения и охрану окружающей среды от воздействия биологических факторов, на предотвращение биологических угроз (опасностей), создание и развитие системы мониторинга биологических рисков». Документ в том числе призван бороться с резистентностью бактерий. Предполагается жестко контролировать продажу антибиотиков, информировать граждан о способах борьбы с проблемой и запретить использование противомикробных препаратов в животноводстве, ветеринарии и сельском хозяйстве без показаний.
Дмитрий Зеленуха, главный семейный доктор клиники «Скандинавия»
— Некоторые распространенные инфекции, такие как пневмония, сальмонеллез, гонорея и туберкулез, становится все сложнее лечить из-за развивающейся антибиотикорезистентности, потому что все сложнее подобрать препараты. Такая ситуация увеличивает время лечения, его стоимость и повышает риск смерти от осложнений, вызванных прогрессирующей бактериальной инфекцией.
Можно привести пример. Человек несколько раз в год пил антибиотик при обычной простуде. Чувствовал себя нормально, разве что на фоне приема могла быть диарея. Простуда, разумеется, проходила сама собой, но пациент был уверен, что помогал антибиотик. Через год или два в силу невезения он резко заболевает тяжелой бактериальной инфекцией. Такое состояние требует больших доз антибиотиков, причем подойдет не каждый. Но лекарства не работают: бактерии просто на них не реагируют. Инфекция становится все тяжелее, вызывая сепсис. Однако стоит отметить, что резистентность развивается у микроорганизма, а не у конкретного человека.
Иногда вирусный процесс осложняется присоединением бактериальной инфекции, и в таком случае врач может назначить антибиотики. Но выписывать их при обычных вирусных заболеваниях в подавляющем большинстве случаев неоправданно.
Таким образом, чем больше людей бесконтрольно пьют антибиотики, тем выше вероятность получить бактерии, суперустойчивые к известным препаратам. Это значит, что все больше людей будет умирать от бактериальных инфекций.
«Неуязвимость»: супербактерии и внутрибольничные инфекции
 Чем чаще бактерии сталкиваются с «оружием», тем совершеннее становится их защита. Бесконтрольное использование человечеством антибиотиков привело к появлению superbugs — видов микроорганизмов, устойчивых к нескольким антибактериальным препаратам сразу. Среди них Neisseria gonorrhoeae (гонорея), Helicobacter pylori (гастрит, язва желудка), Mycobacterium tuberculosis (туберкулез), Salmonellae (лихорадка, диарея), Staphylococcus aureus (менингит, гнойные поражения), Streptococcus pneumoniae (пневмония, инфекции уха, менингит), Enterobacteriaceae (инфекции мочеполовой сферы, желудочно-кишечные заболевания), Acinetobacter baumannii и Pseudomonas aeruginosa (возбудители многих внутрибольничных инфекций) и другие.
Чем чаще бактерии сталкиваются с «оружием», тем совершеннее становится их защита. Бесконтрольное использование человечеством антибиотиков привело к появлению superbugs — видов микроорганизмов, устойчивых к нескольким антибактериальным препаратам сразу. Среди них Neisseria gonorrhoeae (гонорея), Helicobacter pylori (гастрит, язва желудка), Mycobacterium tuberculosis (туберкулез), Salmonellae (лихорадка, диарея), Staphylococcus aureus (менингит, гнойные поражения), Streptococcus pneumoniae (пневмония, инфекции уха, менингит), Enterobacteriaceae (инфекции мочеполовой сферы, желудочно-кишечные заболевания), Acinetobacter baumannii и Pseudomonas aeruginosa (возбудители многих внутрибольничных инфекций) и другие.
Основные места скопления устойчивых бактерий, активно обменивающихся генами резистентности, — больницы. Ситуацию усугубляет тот факт, что в медицинских учреждениях регулярно проводят санитарную обработку, в том числе антибиотиками. Возбуждаемые такими микробами инфекции называют внутрибольничными. От них, по данным ВОЗ, ежегодно в мире умирает около 700 тысяч человек. Опасность в том, что эти инфекции потенциально неизлечимы и устранить их можно только «коктейлем» существующих лекарств или новыми препаратами.
Ольга Тихомирова, доцент кафедры микробиологии Санкт-Петербургского химико-фармацевтического университета, кандидат биологических наук
— Главная сложность в разработке новых препаратов антибиотиков природного происхождения — поиск их продуцентов и получение коммерческих штаммов. Сегодня развивается направление, предполагающее получение полусинтетических производных известных и новых природных антибиотиков. Эти вещества имеют ряд преимуществ: более высокая активность, большая стабильность, снижение токсичности и другие.
Новые вещества с антимикробным действием пытаются создать и химическим синтезом: как модифицируют соединения из известных групп, получая оригинальные производные, так и ведут поиск среди новых групп соединений. Однако часто по активности и токсичности преимуществ у этих соединений нет, и до внедрения в клиническую практику большинство из них не доходит.
Есть надежда на получение химическим синтезом молекул с новыми механизмами действия и мишенями в микробной клетке. Отдельные публикации об этом есть, но о новых коммерческих препаратах пока речь не идет: новые мишени очень часто идут в комбинации с высокой токсичностью препарата и другими пока не решенными проблемами.
К сожалению, в большинстве случаев замены антибиотикам нет. Без эффективно работающих антимикробных препаратов смертность от инфекционных заболеваний вырастет многократно. Вакцинация и иммуноглобулины в ряде случаев помогают не заболеть или вылечиться, однако против большинства возбудителей их не существует.
Как правило, через несколько лет после внедрения в клиническую практику новых антимикробных препаратов уже возникают устойчивые штаммы возбудителей. Скорость возникновения устойчивости зависит как от химической природы действующего вещества, его мишени и механизма действия, так и от соблюдения правил применения препарата.
Момент, когда мы не сможем создавать новые антибиотики, практически уже настал. Прогноз ВОЗ: если не изменить подход к назначению и применению антимикробных препаратов, к 2050 году от заболеваний, вызванных резистентными штаммами, будет умирать 10 миллионов человек ежегодно.
Другое «оружие»: сможем ли мы победить
Ученые постоянно ищут эффективную замену антибиотикам. Так, некоторые возлагают надежды на бактериофаги — естественные вирусы бактерий. Они способны мутировать так же быстро, как и их мишени. Но есть две причины, по которым фагов до сих пор не используют на практике.
Во-первых, на законодательном уровне неясно, можно ли считать вирусы живыми организмами. Если да, то внедрить лекарство на их основе юридически сложно. Во-вторых, преимущество бактериофагов оказывается и их недостатком: сложно предсказать, как они поведут себя, встретившись с иммунной системой человека. К тому же фаги не всегда убивают бактерию и могут подолгу сохраняться в ней в неактивном состоянии.
Получается, достойной замены антибиотикам пока нет, поэтому первый рубеж борьбы с резистентностью — человеческое здравомыслие. Легче предотвратить проблему, чем бороться с ее последствиями. Например, по рекомендациям ВОЗ, врачу следует назначать антибиотики только при реальной необходимости и строго по схеме, а пациенту — соблюдать эти предписания. Также нельзя прописывать антибактериальные препараты себе самостоятельно, прерывать курс лечения или продлевать его без назначения врача.
Не менее важна и профилактика инфекций: соблюдение гигиены, плановая вакцинация, тщательная обработка продуктов питания, защищенный секс. Соблюдение всех этих предписаний поможет снизить контакт бактерий с лекарствами и, соответственно, уменьшить интенсивность развития резистентности у микроорганизмов.
Татьяна Ефименко, старший научный сотрудник сектора поиска природных соединений, преодолевающих устойчивость бактерий ФГБНУ «Научно-исследовательского института по изысканию новых антибиотиков имени Г. Ф. Гаузе»
— Основным источником для выделения микроорганизмов, способных образовывать антимикробные соединения, на протяжении десятилетий была почва. Поэтому на сегодняшний день ее обитатели изучены хорошо и вероятность обнаружения продуцентов новых антибиотиков в почве мала. Ученые ищут выход и исследуют нетрадиционные источники, такие как многолетнемерзлые отложения Антарктики и Арктики, пещеры, морская среда, грибы, животные и растения — в качестве возможных мест обитания микроорганизмов. Кроме этого, анализируют геномы микробов, некультивируемых в искусственных условиях.
Гены устойчивости к антибиотикам возникли еще в древности, однако широко распространилась резистентность после начала использования антимикробных соединений в медицинской практике. Так, пенициллин был открыт Флемингом в 1928 году, широкое применение в медицине начали в 1943 году, а первые сообщения о резистентности появились еще в 1940 году.
Сегодня в качестве альтернативы антибиотикам известны: профилактическая вакцинация, бактериофаговая терапия, световая терапия, терапия ионами серебра и хелатная терапия (подавляет поступление железа в клетки). Но для каждого из этих методов есть ограничения для применения в клинической практике.
Преимущество бактериофагов — высокая специфичность к мишеням, лекарственная переносимость и более низкие темпы возникновения устойчивости у бактерий. Испытания бактериофагов в медицине начались около сотни лет назад, но их так и не стали применять на практике, потому что такую терапию трудно стандартизировать для массового производства и хранения. Немногие вакцины, эффективные для профилактики и лечения наиболее распространенных инфекций, дошли до клинических исследований на людях. Фотодинамическая терапия, наночастицы серебра и хелаторы железа требуют дополнительного изучения для подтверждения эффективности на живых организмах. На данный момент полный отказ от антибиотиков невозможен, но ученые все больше внимания уделяют комбинированным препаратам: антибиотик/ингибитор (подавляет действие ферментов), антибиотик/бактериофаг, антибиотик/наночастицы серебра.
Материал опубликован в журнале NewTone